原发性肝癌统指起源于肝细胞和肝内胆管上皮细胞的恶性肿瘤,其中以肝细胞癌和肝内胆管癌最为常见,但本方案中的大部分内容也适用于肝脏其他类型的原发性肿瘤。病理检查方案主要包括大体标本的固定和取材、大体和显微镜下特点的描述、免疫组化和分子病理学检查等重要环节。规范化的病理检查是从源头上保证病理诊断准确性的基础和前提,由此可为临床评估肝癌复发风险和远期预后以及制订个体化治疗方案提供有价值的参考依据。
(一)大体标本的处理
1.标本固定:
(1)手术医生应在病理申请单上标注送检标本的种类和数量,对手术切缘、可疑病变以及重要血管和胆管切缘可用染料染色或缝线标记,对切除小组织标本及淋巴结等应单独放置容器内并贴好标签说明;
(2)为最大限度地保留细胞内核酸和蛋白质的完整性,防止细胞自溶,应尽可能将肿瘤标本在离体30 min以内送达病理科切开固定;
(3)病理科接收标本后,在不影响病理诊断的前提下切取新鲜组织冻存于组织库,以备分子病理学检查之用,沿瘤体最大直径,每隔1cm做一个剖面,并保持标本的连续性;
(4)常温下10%中性缓冲福尔马林溶液4~5倍于标本体积固定12~24 h。上述处理基本能够满足分子病理学和免疫病理学诊断的需要。
2.标本取材:
根据目前对肝癌异质性和微环境特点的认识,肝癌的外周区域是肿瘤异质性的代表性区域,是高侵袭性细胞群体分布的集中区域,是微血管侵犯和卫星结节形成的高发区域,也是影响转移、复发和预后的高风险区域。为此,应特别重视在癌与癌旁肝组织交界处取材,以便在相互对照中客观评估肝癌的生物学特性。
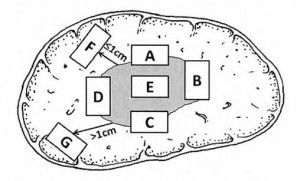
为此,推荐以下肝癌标本“7点”基线取材方案(图1):
(1)选取出血坏死少、组织完整的剖面,分别在12点、3点、6点和9点的位置上于癌与癌旁肝组织交界处取材,癌与癌旁肝组织的比例约为1:1,以着重观察肿瘤对包膜、微血管以及邻近肝组织的侵犯情况;
(2)在肿瘤无出血和坏死的部位至少取材1块,以供分子病理学检查之用,对质地和色泽有差异的肿瘤区域还应增加取材;
(3)对距肿瘤边缘≤1 cm(近癌旁肝组织或切缘)和>1 am(远癌旁肝组织或切缘)范围内的肝组织分别取材,以观察肿瘤卫星结节、异型增生结节以及肝组织背景病变(肝纤维化和肝硬化)等情况;
(4)取材时应做好部位编号,组织块大小为(1.5~2.0)cm×1.0 cm×0.2 om。
编号A、B、c和D:分别对应12点、3点、6点和9点的癌与癌旁肝组织交界处;编号E:肿瘤区域;编号F:近癌旁肝组织区域;编号G:远癌旁肝组织区域
图1肝脏肿瘤标本基线取材部位示意图
建议1:肝癌标本“7点”取材方案是一种基线方案,实际取材的部位和数量还须根据肿瘤的直径、形状、数量以及癌旁肝组织的大小等情况酌情增减;微血管侵犯和卫星结节的检出率还与癌旁肝组织的切除范围有关。因此,应描述癌旁肝组织的大小,并在多剖面检查的基础上,对可疑病灶重点取材(C,I)。
建议2:当肿瘤距肝切缘较近时,可在距肿瘤最近的切缘处做垂直于切缘取材,以实际评估肿瘤与切缘的距离;当肿瘤距切缘较远时,可沿切缘做平行取材,以最大面积评估切缘肝组织的状态(C,I)。
(二)大体标本描述的重点内容
除描述送检肝脏标本的一般特点外,应重点描述肿瘤的大小、数量、颜色、质地、肿瘤与血管和胆管的关系、包膜形成与侵犯、周围肝组织病灶、肝硬化类型、肿瘤至切缘的最近距离以及切缘受累等情况,并对形态特殊的肿瘤标本拍照存档。肝细胞癌的大体分型可参照中国肝癌病理协作组分类和卫生部《原发性肝癌诊疗规范(2011年版)》分类,其中单个肿瘤直径≤1cm为微小癌、>1cm~≤3cm为小肝癌(small hepatocellular carcinoma,SHCC);肝内胆管癌的大体类型可参照世界卫生组织(WHO)的分类,分为块状型、管周浸润型和管内生长型。
SHCC是f临床早诊早治的重要病理学基础,但目前国际上有多个SHCC体积标准,从瘤体直径5cm~2cm不等。有研究显示,SHCC生长至近3cm大小时,是其生物学特性由相对良性向高度恶性转变的重要时期,≤3 cm SHC可出现特定基因的改变。>3cm肝癌发生微血管侵犯、卫星结节以及不良预后的风险明显增加;≤3cm万方数据SHCC患者的术后5年总生存期和无复发生存期分别为67.8%和52%,显著好于>3 cm肝癌患者的42.3%和29.3%(P<0.01)。至于≤2cmSHCC,目前多是基于多中心的长时期病例汇总,单中心报道的病例还较少,生物学特性研究不多。
建议3:≤3 cm SHCC多表现出分化好、膨胀性生长、微血管侵犯和卫星结节发生率低等相对温和的生物学行为,具有根治性治疗的病理学基础;在SHCC出现高侵袭性行为之前进行根治性治疗。对提高肝癌患者远期疗效具有重要的临床实际意义(B,I)。
建议4:SHCC是一个肿瘤体积概念。并不完全等同于生物学意义上的早期肝癌,有些SHCC甚至微小癌也可以出现分化差、侵袭性生长、微血管侵犯和卫星结节形成等恶性生物学行为,提示这类SHCC已较早进入恶性演进阶段。因此。对≤3 cm SHCC的肿瘤组织应全部取材检查生物学行为表现,临床上对≤3 cm SHCC也应注意保留一定的治疗边界(B,I)。
(三)显微镜下描述的重点内容
(1)肝细胞癌的组织学类型:常见有细梁型、粗梁型、假腺管型和团片型等;
(2)肝细胞癌的特殊细胞类型:如透明细胞型、富脂型、梭形细胞型和未分化型等;
(3)肝细胞癌的分化程度:可采用国际上常用的Edmondson-Steiner四级(I-Ⅳ)分级法;
(4)肿瘤坏死(如介入治疗后)、淋巴细胞浸润及间质纤维化的范围和程度;
(5)肝内胆管癌:以腺癌最为常见,也可以出现多种组织学和细胞学特殊类型,分化程度分为高分化、中分化和低分化;
(6)肿瘤生长方式:包括癌周浸润、包膜侵犯或突破、微血管侵犯和卫星结节等;
(7)慢性肝病评估:肝癌常伴随不同程度的慢性病毒性肝炎或肝硬化,应采用公认的组织学分级和分期系统进行评估。
建议5:文献中常用的慢性病毒性肝炎组织学分级和分期系统较多,包括国际肝脏研究学会(IASL)、Knodell、Scheuer、Batts-Ludwig、METAVIR以及Ishak系统等(B,I)。建议在病理诊断工作中选用较为简便的指数系统。例如Scheuer系统与中国2000年慢性病毒性肝炎组织学分级和分期标准基本对应。
建议6:通常应做Masson三色染色和网状纤维染色以辅助评估肝纤维化和肝小叶改建的程度(B,I)。
(四)癌前病变描述的重点内容
1.肝细胞癌癌前病变的主要类型:
(1)肝细胞异型增生:①大细胞改变:肝细胞与细胞核体积均增大,核染色质浓染及多核;②小细胞改变:肝细胞体积缩小,核体积增大伴轻度异型,细胞核呈拥挤表象;
(2)异型增生灶:多由小细胞改变构成的直径≤1.0 mm病灶;
(3)低度异型增生结节(LGDN):以大细胞该变为主构成的结节,细胞无明显异型性,间质内无孤立性动脉,无膨胀性生长;
(4)高度异型增生结节(HGDN):以小细胞改变为主构成的结节,肝细胞异型性增加,间质内出现孤立性动脉,有膨胀性生长,局部发生癌变时称为结节内结节;
(5)肝细胞腺瘤(HCA):WHO将HCA分为HNFlα失活型、β-catenin活化型、炎症型和未分类型等4种亚型,其中β-catenin活化型HCA的癌变风险增加。
2.肝内胆管癌癌前病变的主要类型:
(1)胆管上皮内瘤变(BillN):根据胆管上皮的异型程度,可分为BilIN-1(低级别)、BilIN-2(中级别)和BilIN-3(高级别或原位癌);
(2)胆管内乳头状肿瘤:限于胆管腔内生长的管状哥L头状肿瘤,可伴有不同级别的BillN;
(3)其他:胆管黏液性囊性肿瘤和胆管错构瘤等也可有不同程度的恶变风险,须结合BilIN程度考虑。
建议7:对HGDN与高分化SHCC的鉴别诊断十分重要,后者可不同程度地表现出细胞的核/质比和排列密度增加、小梁间隙增宽、假腺管结构、浸润性生长、CD34染色显示微血管密度增高、Ki-67表达增加、p53和GPC-3阳性表达,以及网状纤维染色显示病灶内网状支架减少或消失等特点。应在与HGDN鉴别的基础上做出诊断(B。I)。
(五)微血管侵犯的病理诊断
微血管侵犯(microvascular invasion,MVI),也称微血管癌栓,主要是指在显微镜下于内皮细胞衬覆的血管腔内见到癌细胞巢团。MVI多见于癌旁肝组织内的门静脉小分支(含肿瘤包膜内血管),这与门静脉血流动力学紊乱,成为肝癌主要的出瘤血管有关。肝静脉分支作为肝癌次要的出瘤血管也可发生MVI,当两者不易区分时诊断MVI即可;偶可见到肝癌侵犯肝动脉、胆管以及淋巴管等脉管小分支,应单独另报;区分脉管的性质可选用CD34(血管内皮)、SMA(血管壁平滑肌层)、弹力纤维(微小血管壁弹力纤维层)以及D2-40(淋巴管内皮)染色等。有研究显示,MVI癌细胞数量≧50个与肝癌患者的预后密切相关,如果脉管内仅有少量松散悬浮癌细胞(<50个),应在病理报告中另行说明,此类MVI被视为低度复发风险。MVI是肝癌术后复发风险的重要预测指标,也是临床肝癌术后抗复发治疗的重要病理学指征。文献资料显示,肝癌MVI的发生率为15%~57.1%不等,这种差异可能与标本取材和诊断标准的不同有关。临床研究表明,MVI与肝癌患者的不良预后,包括复发风险增加和远期生存率降低密切相关,即使≤3 cm SHCC也是如此。Roayaie等的研究显示,MVI发生血管壁肌层侵犯以及MVI数量在5个以上时与术后复发率显著相关,MVI发生于癌旁肝组织>1 cm范围与术后生存率显著相关。Sumie等根据MVI的数量分为无MVI组、轻度MVI组(1~5个MVI)和重度MVI组(>5个MVI)。结果显示,MVI分组越高,患者的疾病特异性生存期和无复发生存期越短。不仅如此,肝移植患者发生MVI也可显著降低移植术后3年无病生存率[RR=3.41(2.05-5.7)]和3年总生存率[RR=2.41(1.72-3.37)]。
此外,Pawlik等发现,MVI的发生与肝癌瘤体大小呈正相关;MVI的发生率在瘤体直径<3 cm、3.1 cm-5 cm、5.1 cm~6.5cm和>6.5cm的肝癌中分别为25%、40%、55%和63%(P<0.01);肝癌的瘤体大小和数量都是预测MVI的重要指标。
建议8:MⅥ是肝癌患者预后的重要预测指标(A,I),应将全部组织切片内的MVI进行计数,并根据MVI的数量和分布情况进行风险分级:M0:未发现MVI;M1(低危组):≤5个MVI,且发生于近癌旁肝组织区域(≤1 cm);M2(高危组):>5个MVI,或MⅥ发生于远癌旁肝组织区域(>1 cm;B,I)。
(六)卫星结节的病理诊断
卫星结节(子灶)主要是指主瘤周边近癌旁肝组织内出现的肉眼或显微镜下小癌灶,与主瘤分离,两者的组织学特点相似。卫星结节起源于MVI,当两者在组织学上不易区分时可诊断为卫星结节。Lim等发现,卫星结节发生率在<5 cm和>5 cm肝癌中分别为7%和23%(P<0.01),是总生存率差的预测因素(P=0.0054)。另有研究显示,92.3%的肝癌标本近端和91.7%的肝癌标本远端出现微转移灶的最大扩散距离分别为<1.5 cm和<3 cm,可作为检查和治疗的重点区域,而且卫星结节还是术后复发风险的重要预测因素。MVI和卫星结节的病理诊断对临床治疗模式的选择也有实际参考价值。例如,Meniconi等发现,首次切除肝癌标本中无MVI和卫星结节的患者出现早期肝内复发时,选择再次肝切除(P=0.01)或射频消融(P=0.007)治疗后的总生存率要明显好于肝动脉插管化疗栓塞。
建议9:卫星结节的病理诊断应包括:(1)卫星结节的数量;(2)卫星结节的分布范围;(3)远癌旁肝组织内出现的癌结节(包括多结节性肝癌)既可能是肝内转移灶,也可能是多中心起源的新生肿瘤,需要时可做分子克隆检测以明确癌灶的来源(B,I)。
(七)肝穿刺活检组织的处理
对肝脏占位性病变通常采用16G穿刺针,于肿瘤及肿瘤旁肝组织交界处穿刺1条,或于肿瘤和肿瘤旁肝组织各穿刺1条,以便相互对照做出正确诊断;评估慢性病毒性肝炎的穿刺组织则需略长,经10%中性缓冲福尔马林固定后长度宜在1.5 cm左右,固定时间1~2 h,并保持组织完整无断裂,在每张玻片上放置≧6张间隔性连续组织切片,以综合评估各组织切片的病损程度|。
三、免疫病理诊断
(一)常用诊断标志物
- 肝细胞癌:
(1)肝细胞抗原(Hep Par-1,肝细胞特异性,不能区别肝细胞性肿瘤的性质);
(2)磷脂酰肌醇蛋白聚糖-3(GPC-3);
(3)CD34(标记肿瘤新生血管);
(4)多克隆性癌胚抗原(pCEA,肝细胞特异性,不能区别肝细胞性肿瘤的性质);
(5)CD10(肝细胞特异性,不能区别肝细胞性肿瘤的性质);
(6)精氨酸酶-1(arginase-1,肝细胞特异性,不能区别肝细胞性肿瘤的性质);
(7)热休克蛋白70(HSP70);
(8)谷氨酰胺合成酶(GS);
(9)甲胎蛋白(AFP)。
2.肝内胆管癌:
(1)细胞角蛋白CK19、CK7;
(2)黏蛋白-1(MUC-1)。
3.双表型肝细胞癌(dual phenotype of hepatocellular carcinoma,DPHCC):是肝细胞癌的一种特殊亚型,表现为形态学上典型的肝细胞癌可同时显著表达肝细胞癌和胆管癌的标志物,因具有双重表型特征而侵袭性更强,只能通过免疫组化检查才能做出亚型诊断。
(二)生物学特性标志物
文献中时有提出与肝癌侵袭能力、复发风险和远期生存等生物学特性相关的免疫组化标志物,但实际应用意义还需要进一步验证。
建议10:现有肝癌标志物在诊断的特异性和敏感性上均存在某种程度的不足。须合理组合、客观评估。有时还需与其他组织特异性标志物联合使用。其主要目的是:(1)肝细胞性良、恶性肿瘤之间的鉴别;(2)肝细胞癌与肝内胆管癌以及肝脏其他特殊类型肿瘤之间的鉴别;(3)原发性肝癌与转移性肝癌之间的鉴别(B,I)。
建议11:CD34免疫组化染色并不直接标记肝脏实质细胞,但可显示不同类型肝脏肿瘤的微血管密度和分布特点:如肝细胞癌为弥漫型、胆管癌为稀疏型、肝细胞腺瘤为斑片型、肝局灶性结节性增生为条索型等,有助于鉴别诊断(B,I)。
四、分子病理诊断
肝癌分子分型是肝癌分子病理学研究发展的方向和趋势,目前文献中时有报道肝癌分子分型和分子预测标志物的检测方案,但其临床实际意义尚有待多中心和大样本的验证。
肝癌药物分子靶点检测的临床应用仍处于研究和开发之中,但一些临床试验结果的进一步验证值得期待。
肝癌术后复发是严重制约肝癌远期疗效的瓶颈之一。肝癌克隆起源理论认为,肝癌存在单中心(单克隆陛)和多中心(多克隆性)两种起源模式。理论上讲,单中心性复发性肝癌来自首次切除肝癌的残留癌细胞,更适合介入和靶向药物等综合治疗,而多中心性复发性肝癌在本质上属于新生肿瘤,更适合再次手术切除或肝移植;由于体内残留癌细胞具有长期“休眠”的生物学特性,即使是临床远期复发(术后>2年)的肝癌仍有可能是单中心性复发。此外,也有学者提出了肝癌复发方式的组织学判断标准,但还需要分子克隆检测的验证。肝癌克隆起源理论也同样适用于多结节性肝癌的发生。Finkelstein等报道,多中心起源的多结节性肝癌患者的肝移植术后生存期要明显好于单中心起源的多结节性肝癌,提示分子克隆检测可为肝移植受体的筛选以及预后评估提供参考依据。Gehrau等还提出了一个肝癌诊疗路线图,其中对多结节性肝癌若经分子检测证实为多中心起源,可进入肝移植候选评估队列,如果是单中心起源,则侧重介入治疗或索拉非尼靶向药物治疗。
对肝细胞腺瘤癌变风险的分子评估及对临床治疗模式的影响也已引起关注。总之,围绕临床关切开展肝癌分子病理诊断,有助于临床治疗模式的优化与更新。
建议12:多结节性肝癌和复发性肝癌的克隆起源方式是临床制订个体化治疗方案和提高远期疗效的重要关切。为此。采用分子克隆检测的方法评估这类肝癌的克隆起源方式,可为临床制订个体化治疗方案提供客观的参考依据(B,I)。
五、病理诊断报告
肝癌病理诊断报告应突出肝脏专科病理特点,注重回应临床对了解肝癌术后复发病理危险因素的关切。肝癌病理诊断报告一般由大体标本描述、显微镜下描述、免疫组化检查结果、其他特殊检查结果、典型病理照片以及病理诊断名称等部分组成,必要时还可以通过备注的方式,对临床需要引起重视的肿瘤重要生物学特征或病理学上还有待进一步鉴别诊断的病变等问题加以解释或补充说明。此外,为便于记录和统计临床和病理学参数,也可以在病理报告后附加清单式记录表格。
附:病理诊断报告模式举例
- 大体所见:
(1)肝右叶标本5.0 cm×4.5 cm×4.2 cm,切面见2.6 cm×2.2 cm灰白色肿瘤,伴灶性出血坏死,周边包膜完整,周围肝组织呈大结节性肝硬化,未发现癌栓及卫星结节,肿瘤距手术切缘1.5 cm;(2)肝左叶标本3.0 cm×2.0 cm×2.2 cm,切面见肝硬化组织内有1个直径1.0 cm×0.9 cm灰白色结节,无包膜,与周围肝组织分界清楚。
2.镜下所见:(1)肝右叶肿瘤排列成细梁型结构,癌细胞多边形,细胞质丰富嗜酸性,细胞核圆形,轻度异型,癌组织与周围肝组织有移行,包膜内见1个MVI,近癌旁肝组织内见2个MVI;周围肝组织呈假小叶结构,可见1个由大细胞改变构成的异型增生灶,对周围肝组织有膨胀性挤压,远癌旁肝组织及切缘肝组织内未见肿瘤细胞。(2)肝左叶肿瘤排列成假腺管结构,癌细胞小立方形,核异型性不明显,肿瘤周边无包膜,与肝组织分界清楚(可附典型组织学照片)。
3.免疫组化检查结果:Hep Par l阳性;GPC-3阳性;HBsAg阳性;CD34显示微血管弥漫分布;假腺管区域GPC-3阳性,CK19阴性。
4.特殊染色检查结果:Masson三色染色显示肝组织胶原纤维间隔形成,包绕假小叶;网状纤维染色显示假小叶网状支架塌陷。
5.分子病理学检查结果:肝左叶和肝右叶肿瘤之间的微卫星杂合性缺失类型出现显著性差异。提示为2个起源于不同克隆的原发性肿瘤(可另附分子病理学检查报告)。
6.病理诊断:(1)(肝右叶)小肝细胞癌,细梁型,Ⅱ级;(2)(肝左叶)小肝细胞癌,假腺管型,Ⅱ级;(3)MVI评级=M1;(4)大结节性肝硬化;(5)癌旁肝组织异型增生灶。
7.备注:本例2个肝癌结节均为原发,癌旁肝硬化组织内出现异型增生灶,提示存在肿瘤多中心起源的病理基础,请临床注意密切随访。
本指南摘自 中华肝胆外科杂志2015年3月第21卷第3期 中国抗癌协会肝癌专业委员会,中华医学会肝病学分会肝癌学组,中国抗癌协会病理专业委员会,中华医学会病理学分会消化病学组,中华医学会外科学分会肝脏外科学组,中国抗癌协会临床肿瘤学协作专业委员会,全国肝胆肿瘤及移植病理协作组
 李文华的博客
李文华的博客